Страница: 4/7
Механизм кооперативности В 1963 году Моно, Шанже и Джекоб обнаружили, что активность некоторых ферментов меняется скачком между двумя значениями при воздействии на белок некоторых низкомолекулярных агентов, не принимающих участия непосредственно в каталитическом акте. Такие ферменты получили название аллостерических, а само явление – аллостерии. Предполагается, что эти ферменты могут находиться в разных состояниях, переключение между которыми осуществляется при присоединении специфического низкомолекулярного лиганда (необязательно вблизи активного центра). В 1965 году Моно, Уайман и Шанже поняли, что гемоглобин, не являясь ферментом, принадлежит к тому же классу белков. К тому времени уже было известно, что структуры глобул оксигемоглобина и гемоглобина различны, и авторы предположили, что состояния с разными значениями констант оксигенации соответствуют различным пространственным структурам белка. Для гемоглобина постулируется наличие двух таких состояний: R (от англ. relaxed) и Т (от англ. tense). Состояние R характеризуется высоким, а Т – низким сродством к О2 (сильнее и слабее связывают молекулярный кислород соответственно). В рамках этой концепции считается, что как в R-, так и в Т-состоянии сродство к кислороду субъединиц одной глобулы (т.е. есть всех четырех гемов одной глобулы) одинаково. Этот постулат позволяет построить сравнительно простую математическую модель кооперативных свойств гемоглобина: КR, КТ и L (константы равновесия реакций ассоциации в состояниях R, Т и отношение числа молекул гемоглобина в состояниях Т и R соответственно). На рис.2, б ясно, что КТ<КR. Очевидно, увеличение константы ассоциации при переходе из состояния Т в состояние R соответствует в расчете на один гем изменению свободной энергии системы
DG = 2,3 RT lg(KR/KT) кДж/моль. (7)
Для гемоглобина человека при 37°С эта "свободная энергия кооперативности" равна 5,61 кДж/моль. В физиологических условиях при отсутствии кислорода лишь ~ 3·10-5 % молекул гемоглобина находятся в R-форме, а в условиях полного насыщения кислородом лишь ~ 7-10-3 % — в Т-форме. [2]
Изменения электронной и пространственной структуры гемоглобина в процессе оксигенации На рис.4 схематически показаны электронная структура железа гема, положение атома железа относительно плоскости порфиринового кольца гема, спектральные и магнитные характеристики молекул в различных состояниях молекулы гемоглобина: дезоксигемоглобин, оксигемоглобин и ферригемоглобин. Следует подчеркнуть, что во всех случаях речь идет о равновесных состояниях молекул белка. Мы увидим далее, что переход из одного состояния в другое требует значительного (в молекулярных масштабах) времени, в течение которого система проходит через несколько неравновесных состояний, заметно отличающихся по своим физическим и химическим свойствам от равновесных. [2]
В молекуле дезоксигемоглобина железо отстоит от плоскости порфиринового кольца примерно на 0,5-0,6 А° (есть небольшие отличия между a- и b-субъединицами). Из шести 3d электронов железа Fe(II) два электрона спарены на одной из низших d-орбиталей (dxy, dyz, dxs), а четыре электрона занимают оставшиеся d-орбитали, их спиновые моменты, согласно правилу Хунда, параллельны и суммарный спин S-2. Магнитный момент гема в этом состоянии равен ~ 5,5 боровского магнетона (БМ), а спектр поглощения в зеленой области имеет характерную полосу с lmax ~ 556 нм. Присоединение кислорода ведет к значительным изменениям. Атом железа в оксигемоглобине лежит практически в плоскости порфиринового кольца (расстояние до плоскости составляет 0,16 А° в α- и 0,00 А° в β- субъединицах). Все шесть d-электронов спарены на трех низших d-орбиталях, S= 0, оксигемоглобин диамагнитен. В зеленой области спектра имеются две характерные полосы поглощения: а (lmax 576 А°) и b (542 А°).
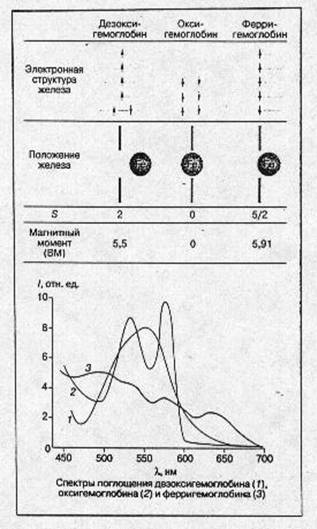
Рис.4. Основные характеристики молекулы гемоглобина в различных состояниях.
В ферригемоглобине (метгемоглобин) при нейтральных значениях рН место кислорода занимает молекула воды (при щелочных значениях рН-ОН), железо находится значительно ближе к плоскости гема, чем в дезоксигемоглобине, все пять d-электронов неспарены и занимают пять d-орбиталей. S = 5/2 и магнитный момент равен 5,91 БМ.
Структурные изменения в активном центре (вблизи гема) приводят и к значительным изменениям пространственной структуры всего белка. При оксигенации (переход от Т- к R-форме) смещение отдельных аминокислотных остатков достигает 7 А°. Как уже было сказано выше, четвертичная структура гемоглобина характеризуется наличием четырех полипептидных цепей, образующих две (a- и две b-субъединицы). Более детальные исследования показали, что субъединицы образуют ab-димеры. ТÞR – переход сопровождается поворотом одного димера относительно другого на 12-15° и в конечном счете приводит к увеличению карманов, в которых находятся гемы. Эти структурные изменения инициируются присоединением первой молекулы О2 к одному из свободных гемов и распространяются на всю глобулу. Именно поэтому в равновесной смеси всегда присутствуют только Т- и R-формы. Эти димеры в Т-форме стягиваются 14 дополнительными (по сравнению с R-формой) солевыми мостиками (водородные связи между ионными или нейтральными группами аминоксилот, ван-дер-ваальсовы контакты). Кроме того, между b-субъединицами в Т-форме присоединяется молекула дифосфоглицерата, что также приводит к сужению карманов. Эти изменения схематически представлены на рис.5.
Триггером для всех описанных выше структурных перестроек при переходах между Т- и R-формами и обратно служит присоединение или отщепление кислорода. После локального элементарного химического акта: присоединение или отщепление низкомолекулярного лиганда, окисление железа при образовании ферригемоглобина (иначе говоря, после появлении лишнего положительного заряда на железе) – возникает существенно неравновесное конформационное состояние – изменения вблизи активного центра уже произошли, а вся огромная молекула белка осталась в прежнем, еще не отрелаксировавшем состоянии. Последующая релаксация может занимать микросекунды и даже секунды. В ходе этой релаксации меняются не только физические, но и химические свойства белка, в частности скорости последующих химических актов, если они успевают произойти до полного завершения релаксации. Таким образом, описанная выше картина процессов, сопровождающих обратимое связывание кислорода гемоглобином, является лишь первым, хотя и очень важным приближением к истине. Так, например, быстрое восстановление железа в ферригемоглобине коротким (микро- или наносекунды) импульсом электронов приводит к возникновению неравновесного состояния, в котором железо уже восстановлено, но не отошло от плоскости порфиринового кольца. По спектральным и магнитным характеристикам это состояние соответствует равновесному оксигемоглобину. Релаксация гема и его ближайшего окружения с удалением железа от плоскости порфиринового кольца занимает при комнатной температуре десятки микросекунд, а полная релаксация всей белковой глобулы к равновесной Т-форме дезоксигемоглобина — сотни миллисекунд.
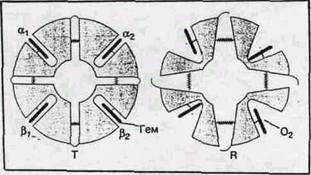
Рис. 5. Структурная схема перехода гемоглобина от Т- к R-форме
Другие реакции и функции гемоглобина При взаимодействии молекулярного кислорода с гемоглобином существует небольшая, но конечная вероятность окисления последнего: молекула О2 не присоединится, но окислит железо: Fe2+ + O2 Þ Fe3+ O2-. Поэтому при дыхании в эритроцитах непрерывно образуется метгемоглобин. Для его восстановления в эритроците существует специальная ферментативная система, восстанавливающая метгемоглобин и превращающая его в нормальный дезоксигемоглобин. При нарушении этой системы возникает тяжелое заболевание — метгемоглобинемия, при котором гемоглобин перестает быть переносчиком кислорода.
Гены, ответственные за синтез гемоглобина, могут подвергаться мутациям, меняющим структуру и функции белка. Наиболее изучена мутация, приводящая к замене только одной аминокислоты в полпептидных цепочках b-субъединиц гемоглобина. Замена глутамина на валин ведет к тяжелой болезни – серповидноклеточной анемии: эритроциты принимают форму серпа и теряют способность переносить кислород.
Присоединение кислорода меняет кислотно-основные свойства гемоглобина. Оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Поэтому в тканях, где значительная часть гемоглобина теряет кислород и становится более сильным основанием, гемоглобин связывает образующуюся в ходе метаболических внутриклеточных процессов углекислоту. В альвеолах легких дезоксигемоглобин снова превращается в оксигемоглобин, становится более сильной кислотой и способствует отщеплению СО2. Это слегка упрощенное описание важного процесса транспорта углекислоты эритроцитами. Углекислота, освобождаемая тканями, недостаточно хорошо растворима для эффективного переноса. С помощью фермента карбоангидразы, ускоряющего прямую и обратную реакцию
СО2+Н2ОÛНСО3-+Н+ (8)
двуокись углерода превращается в хорошо растворимый бикарбонат-анион. В капиллярах тканей отщепление кислорода повышает содержание дезоксигемоглобина, связывающего протоны и смещающего, таким образом, равновесие реакции (8) вправо. Легко растворимый ион бикарбоната переносится кровью. В альвеолах легких гемоглобин оксигенируется, протоны освобождаются и равновесие (8) смещается влево. Образуется плохо растворимая двуокись углерода СО2, которая удаляется из водной фазы и выдыхается. Таким образом, гемоглобин работает как буфер с переменным значением pK. Функция гемоглобина как переносчика углекислоты не менее важна, чем его функция переносчика кислорода.
Реферат опубликован: 8/04/2005 (18087 прочтено)