Страница: 1/4
Первичные факторы в этиологии и патогенезе воспалительных заболеваний пародонта
Этиология и патогенез воспалительных заболеваний пародонта окончательно не установлены. С начала XX века до 60-х годов в центре внимания стояли вопросы общих заболеваний организма, окклюзии. В 60-70-е годы на первое место была поставлена проблема зубной бляшки и ее роли в развитии воспалительных изменений в пародонте. Впервые о ведущей роли микроорганизмов зубного налета в этиологии гингивита сообщил Зоненверт (1958), выделив ферменты агрессивности. В 1963 году Розбери подтвердил эту точку зрения. В настоящее время клинически и экспериментально установлено:
без бляшки нет пародонтита
Причинные факторы воспалительных заболеваний пародонта разделяют на первичные и вторичные.
К первичному комплексу причин относится зубная бляшка и вызванные ее воспалительные реакции пародонта
Вторичный комплекс причин охватывает местные и системные факторы, позволяющие реализоваться составляющим первичного комплекса. Длительное время (с начала 60-х до середины 80-х годов XX столетия) воспалительные заболевания пародонта рассматривались как следствие неспецифического инфицирования микроорганизмами зубной бляшки (гипотеза о неспецифическом инфицировании налетом). Исходили из того, что пародонтит развивается из-за увеличения количества бактерий зубной бляшки. Сомнение в ее неспецифичности возникли тогда, когда в эксперименте выяснилось, что не у всех подопытных собак, несмотря на увеличение биомассы зубной бляшки, определялся пародонтит.
В 1975-1983 годах на первое место вышла гипотеза специфичной микрофлоры зубной бляшки (т.н. специфическая гипотеза налета). Благодаря исследованиям Slots F. (1979), Loesche W. (1992) и др. в полости рта были обнаружены новые микроорганизмы и признано существование пародонтопатогенных бактерий.
Тот факт, что специфические бактерии имеются в полости рта, позволил ввести в 1985 году теорию оппортунистической инфекции.
Сегодня считают, что при определенных формах пародонтита специфичность бактерий стимулируется тем, что находящиеся в зубном налете микроорганизмы развиваются под экзогенным или эндогенным влиянием и вытесняют другие бактерии. Поэтому воспалительные заболевания пародонта теперь рассматривают как оппортунистическую инфекцию, зависящую не только от присутствия патогенных бактерий, но и от среды способствующей их размножению (локальные изменения РН, анаэробная ниша, изменения резистентности организма и др.)
Различают наддесневую и поддесневую зубную бляшку. Первая состоит преимущественно из грамположительных микроорганизмов, вторая - из грамотрицательных. При здоровых деснах на зубах определяется небольшое количество бляшки, состоящее из грамположительных бактерий: Str. mitior, Str. sanguis, актиномицет (A. naeslundii и A. viscosus), коринобактерий, а также незначительного числа грамотрицательных кокков (Neisseria, Veillonella).
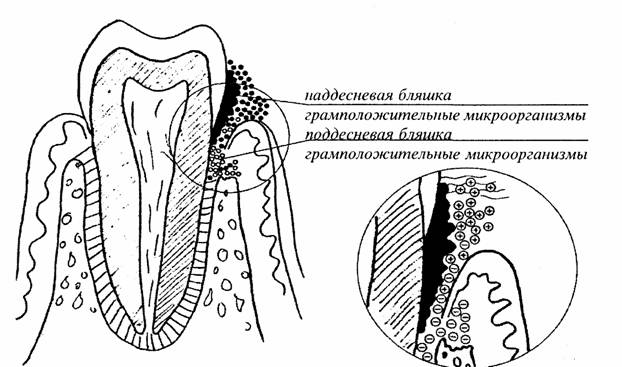
Результаты микробиологических исследований при гингивите показывают рост количества актиномицетов (особенно A. viscosus), трепонем, а также грамотрицательных палочек (Fusobacterium nucleatum) и кокков (Veillonella parvula). Увеличение же количества и вирулентности бактерий поддесневой зубной бляшки способно вызывать пародонтит.
Собственно его можно рассматривать как следствие атаки микроорганизмами поддесневой зубной бляшки при благоприятных для них условиях тканей пародонта. По данным Flemmig F. и Karch H. (1998), лишь несколько из более 500 установленных видов бактерий, находящихся в поддесневой бляшке, связаны с этиологией маргинального пародонтита. На их микробиологических характеристиках остановимся подробней.
Микробиология поддесневой зубной бляшки
За возникновение и развитие воспалительных изменений в тканях пародонта наиболее ответственны следующие микроорганизмы: actinobacillus actinomycetem comitans, Porphyromonas gingivalis, Bacteroides forsythus, Prevotella intermedia, Prevotella melanogenica, Peptostreptococcus, Fusobacterium nucleatum, Actimomycetus viscosus, odontolyticus, israeli, naeslundii, veillonella parvula.
Actinobacillus actinomycetem comitans входит в состав нормальной микрофлоры полости рта. Факторы патогенности - капсула, компоненты которой ингибируют синтез ДНК и коллагена (что вызывает повреждение околозубных тканей при воспалительных поражениях пародонта); лейкотоксин, вызывающий гибель нейтрофилов, и бактериоцин, губящий конкурентные микроорганизмы.
Porphyromas gingivalis образует индол, связывает и разрушает фибриноген, секретирует коллагеназу, агглютинирует эритроциты.
Bacteroides forsythus, как и другие бактероиды, обладают способностью к адгезии к поверхности эпителия и выделяет продукты, повреждающие его. Установлено, что без присутствия бактероидов невозможно воссоздать экспериментальную модель пародонтита и гингивита.
Prevotella intermedia, Prevotella melanogenica продуцируют фосфолипазу А, нарушающую целостность мембран эпителиальных клеток, что вызывает их гибель.
Пептострептококки обладают высокими адгезивными свойствами по отношению к эпителию и эмали зуба, агрегируют с другими бактериями полости рта, и образуют с ними ассоциации.
Fusobacterium nucleatum образуют индол, секретирует фосфолипазу А, лейкоцитин, который оказывает цитотоксическое действие на различные клетки.
Основные виды актиномицетов (Actinomycetus viscosus, A. odontolyticus, A. naeslundii, A. israeli) при ферментации углеводов образуют кислые продукты, проявляющие агрессивность по отношению к твердым тканям зубов. Увеличение числа актиномицетов (особенно A. viscosus) в наддесневой зубной бляшке приводит к развитию острого гингивита. A. viscosus выделяют из зубных камней и пришеечных кариозных поражений.
Veillonella parvula самостоятельно обычно не вызывает развитие патологических процессов, но может входить в состав смешанных групп патогенов либо вызывать вторичные инфекции. Содержит ферменты, нейтрализующие кислые продукты метаболизма других бактерий, является антагонистом кариесогенных стрептококков.
Антигены, токсины зубной бляшки повышают проницаемость эпителия десневой борозды. Это увеличивает выделение сулькулярной жидкости. Под влиянием последней, бактерии совместно с лейкотоксинами (полипептид, выделенный из экссудата, способный активизировать комплекс антиген-антитело повышают проницаемость капилляров, способствуя выходу в соединительную ткань десны и десневую жидкость полиморфно-ядерных лейкоцитов. В результате их альтерации выделяются лизосомальные ферменты - стартовые площадки воспаления по Струкову.
В «западной» литературе наиболее распространенной концепцией патогенеза пародонтита является концепция Page R. и Schroder H. (1978). По ней различают такие поражения:
• начальное;
• раннее;
• открытое;
• прогрессирующее.
Начальное поражение пародонта развивается из клинически здоровой десны в течение 2-4 дней после аккумуляции бляшки. Это состояние полностью обратимо. Клинически оно не определяется.
Раннее поражение пародонта развивается в течение 14 дней при отсутствии лечения начального поражения. Клинически соответствует острому гингивиту.
Открытое поражение пародонта у взрослых развивается в течение нескольких недель после раннего поражения. Клинически проявляется хроническим гингивитом или переходом последнего в пародонтит. Может быть полностью обратимым при надлежащей гигиене полости рта.
Прогрессирующее поражение представляет собой деструктивный процесс в тканях пародонта. Одними гигиеническими мероприятиями уже невозможно достичь восстановления разрушенных тканей.
В таблице 2 указаны патоморфологические характеристики выше описанных поражений.
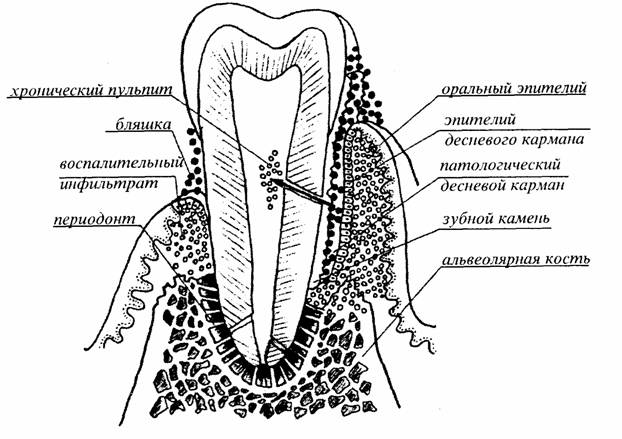
Нарастание воспалительно-дистрофических явлений в тканях пародонта приводит к разрушению альвеолярной кости. Последнее обусловлено погружным ростом эпителия и грануляций, простаг-ландином Е2, лимфокинами и др.
Патогенез пародонтита во многом обусловлен неспецифической защитой, специфическими иммунологическими процессами, действием медиаторов воспаления.
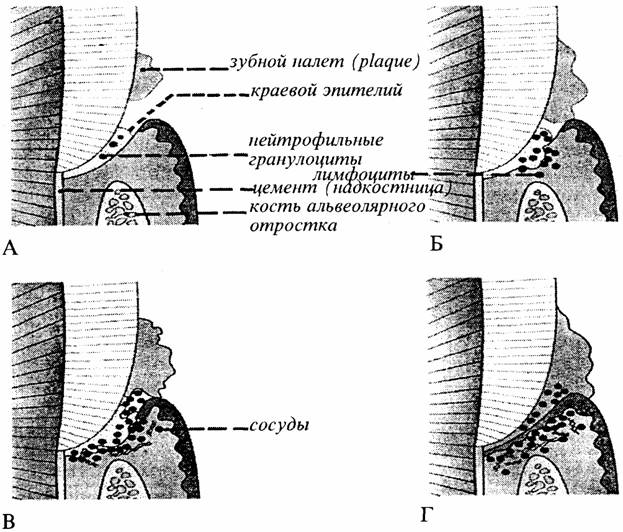
А - клинически здоровая десна. Наддесневой налет, в краевом эпителии появляются единичные полиморфные ядерные нейтрофильные гранулоциты;
Б—начальный этап. Налет в десневой борозде (sulcus), возрастающее проникание гранулоцитов, первые признаки ослабления эпителия, увеличенная проницаемость сосудов, появление лимфоцитов, начало разрушения коллагена соединительной ткани;
В —ранний этап воспаления. Трещины в эпителии, увеличение количества сосудов, появление воспалительных отеков (лимфоциты), отчетливое разрушение коллагена, увеличение проницаемости сосудов.
Г— хроническое воспаление. Отчетливое образование десневого кармана (патологический карман), дальнейшее разрушение соединительной ткани, значительное выделение нейтрофилъных абсорбирующих гранулоцитов, последующие изменения сосудов.
Неспецифическая защита
При воспалении в тканях пародонта, вследствие повышенной проницаемости сосудов, увеличивается поток сулькулярной жидкости, усиливается миграция полиморфноядерных лейкоцитов, которые являются важнейшим элементом неспецифической защитной системы крови. Они фагоцитируют бактерии, продукты распада тканей и разрушают их своими лизосомными ферментами (такими, как протеазы, пептидазы, оксидазы, дезоксирибонуклеазы и липазы). Из клеточных мембран активизированных полиморфноядерных лейкоцитов выделяется арахидоновая кислота - ненасыщенная жирная кислота, которая служит предшественником лейкотриенов, тромбоксанов и простагландинов. Эта группа веществ играет важную роль в запуске воспаления, регуляции просвета и проницаемости кровеносных сосудов.
Реферат опубликован: 16/06/2005 (9833 прочтено)