Страница: 2/10
В возникновении сальмонеллеза ведущую роль играют живые бактерии, гибель которых в организме больного сопровождается развитием эндотоксинемии. Принято выделять два вида токсичных продуктов жизнедеятельности микробов-экзотоксии и эндотоксии. К экзотоксинам отнесены токсичные продукты жизнедеятельности бактерий, активно (при жизни) секретируемые в окружающую среду, а к эндотоксинам – те ядовитые для макроорганизма продукты жизнедеятельности, которые освобождаются только при лизисе микробной клетки [6].
Кроме токсина палочка имеет ряд антигенов клеточной стенки. О-антиген расположен на поверхности микробной клетки и представляет собой фосфолипидно-полисахаридный комплекс, включающий 60 % полисахарида, 20-30 % липида и 3-4,5 % гексозамина. Н-антиген определяется жгутиками. Поверхностные антигены клеточной стенки провоцируют типоспецифический антительный ответ, а глубинные – видоспецифический [6,7].
При сальмонеллезе развитие и тяжесть симптомов обусловлены интоксикацией и обезвоживанием. По мнению А.Ф. Билибина интоксикация – явление сложное, сводящееся к изменению нервнорефлекторной деятельности и гуморальной регуляции с обменными сдвигами. К.В. Бунин в основу синдрома интоксикации ставит воздействие токсина на :
падение артериального давления, снижение сократительной способности миокарда;
гормональную регуляцию водно-солевого обмена с изменениями биосинтеза гормонов в коре надпочечников с угнетением процесса их метаболизма;
функцию почек (снижение клубочковой фильтрации, повышение канальцевой реабсорбции воды, снижение концентрации очищения мочевины) [8].
Сальмонеллезная интоксикация возникает как результат патологии первичного ответа на инфекционный агент вследствие значительных потерь воды и электролитов с рвотой и жидким стулом. По мере увеличения дефицита воды и электролитов на первый план выступают симптомы обезвоживания и поражения ЦНС. Если процесс прогрессирует, обезвоживание нарастает, появляются признаки недостаточности кровообращения, которые при интоксикации имеют клинику шока. Частая рвота и понос – первые признаки интоксикации [9].
Обязательным условием развития заболевания являются наличие большого количества возбудителей и их токсинов, массовое проникновение антигенов в кровь. Наибольшей токсичностью отличается липид А, вызывающий следующие основные реакции: активацию лейкоцитов и макрофагов, стимуляцию выброса эндогенного пирогена, антогониста глюкокортикоидов, интерферона, интерлейкинов, подавление тканевого дыхания, активацию системы комплемента, тромбоцитов, факторов свертывания крови другие [10,11], [рис. 1.1.1].
Главной причиной развития шока при сальмонеллезе считается не повреждающее действие самих микробов или их токсинов, а своеобразный ответ организма на них. Под токсико-инфекционным шоком следует понимать экстремальное состояние организма, наступающее в результате действия токсичных субстанций возбудителей, патогенных иммунных комплексов на органы и ткани организма, сопровождающееся острым нарушением метаболизма в них [12].
Схематическое изображение липополисахаридов
стенок микробов.

Рис. 1.1.1.
С.А. Степанов с помощью аспирационной биопсии обнаружил в тонкой кишке больных сальмонеллезом изменение эпителия, острое воспаление слизистой оболочки, нарушение микроциркуляции и сосудистой проницаемости. К.Х. Ходжаев в эксперименте на крысах показал, что сальмонеллезная инфекция вызывает нарушение процесов тканевого дыхания и фосфорилирования. Состояние поджелудочной железы изучено Белянской Т.А. В острый период болезни отмечено снижение ферментативной активности панкреатического сока – уровень трипсина был снижен в 71 % случаев, липазы в 55 %, амилазы – в 66 %.
Таким образом эндотоксин вызывает активацию синтеза, преимущественно протеолитических ферментов, задержку экструзии секретируемых проэнзимов, что приводит к секреции и поступлению ферментов в лимфатическое и кровеносное русло [13,14].
При сальмонеллезе развивается обезвоживание, обусловленное потерей внеклеточной жидкости, а при тяжелом течении заболевания и части клеточной. Дегидратация в большинстве случаев имеет изотонический характер, сочетаясь с развитием сгущения крови, дефицитом электролитов, метаболическим ацидозом в капиллярной и венозной крови [15], [рис. 1.1.2].
Молекулярные механизмы развития эндогенной
интоксикации при сальмонеллезе
Явления интоксикации вызывают заболевания, сопровождающиеся повышенным распадом тканей, усиленными процессами катаболизма, недостаточностью функции печени и почек, снижением процессов микроциркуляции [16].
В ответ на действие первичного патогена, которым являются эндотоксины, сальмонелл, в организме развиваются типовые каскадные реакции, что лежит в основе современной концепции СЭИ.
На Международном симпозиуме в Санкт-Петербурге (1994 г) было дано определение этого синдрома как клинического синдрома с проявлением симптомов интоксикации при патологических состояниях неоднородных по этиологии и обуславливающих накопление в тканях и биологических жидкостях организма продуктов патологического обмена веществ, метаболитов, деструкции клеточных и тканевых структур, разрушения белковых молекул [17,18].
Шано В.П. с соавторами подчеркивает, что токсическое влияние липополисахаридной субстанции эндотоксина проявляется комплексом нарушений, обусловленных повреждением как циркулирующих клеток в кровотоке, так и эндотелиоцитов, эозинофилов, нейтрофилов, макрофагов, следствием чего является выброс в кровоток ряда биологически активных веществ – цитокинов, интерлейкинов. Главной точкой приложения эндотоксина являются эндотелиальные клетки, активация их приводит к высвобождению простациклина, выделению эластазы, токсических метаболитов кислорода, факторов активации тромбоцитов и комплемента с высвобождением терминального комплекса комплемента, брадикинина с последующим формированием синдрома повышенной проницаемости капилляров. Это приводит к тому, что в очаг воспаления начинают входить компоненты крови, прежде всего фибриноген и тромбоциты. Фибрин способствует агрегации тромбоцитов, полимеризации фибрина и – возникновению тромбов. Следствием тромбоза являются нарушения микроциркуляции с последующей гипоксией, что приводит к дальнейшим повреждениям клеток в очаге воспаления. Метаболическим результатом этого является изменение аэробного метаболизма клеток на анаэробный, повышенное продуцирование лактата и протонов, снижение показателей рН [19].
Среди тканевых (клеточных) медиаторов воспаления важное место занимают простагландины. Исходными продуктами для биосинтеза простагландинов являются ненасыщенные жирные кислоты: линолевая, арахидоновая, пентаноевая. Наибольшее значение имеет в организме арахидоновая кислота, которая содержится в фосфолипидах клеточных мембран.
Простагландины вызывают сильное диуретическое и натрийуретическое действие, оказывают разнообразное действие на желудочно-кишечный тракт. Они могут стимулировать и тормозить сокращение и секреторную активность тонкой кишки, тормозят секрецию соляной кислоты слизистой оболочки желудка. Простагландины вызывают секрецию воды и электролитов в просвет кишки, вызывая диарею, повышают концентрацию ц-АМФ в слизистой оболочке тонкой кишки, влияют на прочность и упругость эритроцитарной мембраны [20, 21, 22, 49].
Показатели уровня эндогенной интоксикации
организма при сальмонеллезе
Анализируя данные литературы за последние десятилетия, можно сказать, что
основными показателями интоксикации при сальмонеллезе являются ПОЛ, уровня холестерина,
ЦИК, ИТ, МСМ и активность каталазы. При развитии интоксикации на фоне сальмонеллеза
происходит активный хемотаксис нейтрофиллов в очаг воспаления, где они поглощая
и переваривая чужеродный агент, изменяют свою метаболическую активность, характеризующуюся
усилением поглощения кислорода, повышенной утилизацией глюкозы и гиперпродукцией
АФК (![]() ) [23, 24].
) [23, 24].
Перекисное окисление является универсальным механизмом взаимодействия кислорода со многими органическими субстратами, в том числе с липидами. Внедрение кислорода в молекулы окисленного субстрата приводит к образованию реакционно-способных промежуточных продуктов – свободных радикалов, гидроперекисей, которые в дальнейшем вызывают повреждение других классов соединений – белков, нуклеиновых кислот, углеводов (рис. 1.3.1).
Метаболизм супероксидного радикала в норме
и при патологии (Владимиров Ю.Я., 1998)
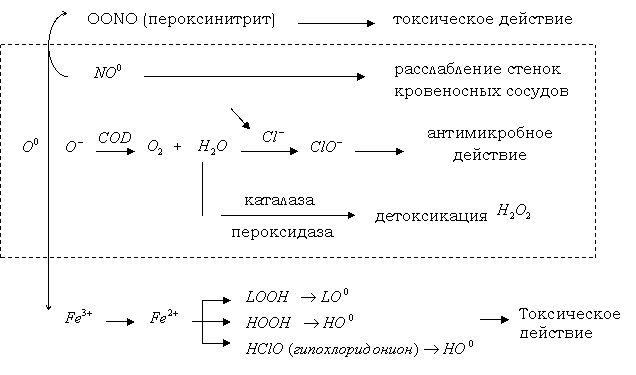
Рис. 1.3.1.
Накопленные к настоящему времени данные литературы позволяют сделать вывод о том, что свободнорадикальное окисление липидов при сальмонеллезной инфекции играет определенную патогенетическую роль [25, 50].
Установлено, что при развитии ПОЛ в биомембранах понижается содержание легкоокисляемых полиненасыщенных жирных кислот и изменяются физико-химические свойства: микровязкость, текучесть, мембранный потенциал, полярность внутренних областей мембран. Таким образом, изменяются транспортные свойства мембраны и активность ферментов [26].
Регуляция свободнорадикального окисления обеспечивается в клетке системой антиоксидантной защиты. Так, накапливающаяся в процессе ПОЛ перекись водорода обезвреживается с помощью каталазы, присутствующей во всех тканях организма. Каталаза (КФ 1.11.1.6.) представляет собой гемсодержащий фермент с молекулярной массой около 250000 Д, локализованный в пероксисомах клеток [27].
Митохондриальная каталаза участвует в оксидазном пути окисления, сопровождающемся запасанием энергии в виде АТФ. Блокирование транспорта электронов в дыхательной цепи приводит к стимуляции пероксисомального окисления. При потологиях, связанных с нарушением энергетических процессов, каталаза пероксисом может выходить из них и участвовать в окислении на мембранах эндоплазматического ретикулума [28, 53].
В работе Л.Б. Оконенко с соавторами о состоянии антиоксидантной системы судили по активности СОД, глутатионпероксидазы и каталазы, анализ данных выявил дефицит антиоксидантов [29, 30].
При инфекционном токсикозе в мембранах эритроцитов резко снижается содержание общих фосфолипидов, но увеличивается количество НЭЖК и лизофосфотидилхолина, что косвенно указывает на повышение активности фосфолилаз, которые избирательно разрушают липиды мембран. Холестерин подвергается как активному, так и пассивному обмену в мембранах эритроцитов [29]. Фермент лецитинхолестеролацил трансфераза превращает эфиры холестерина в свободный холестерин и тем самым регулирует уровень свободного холестерина в плазме, что способствует проникновению его в мембраны. Следовательно, инактивация этого фермента в результате гипоксии при эндотоксикозе ведет к повышению уровня эфиров холестерина в мембранах эритроцитов [31,32].
Наряду с уровнем МДА, активности каталазы и уровня холестерина для диагностики заболевания и его прогноза имеют значение и другие неспецифические показатели – ЦИК, Ит, МСМ.
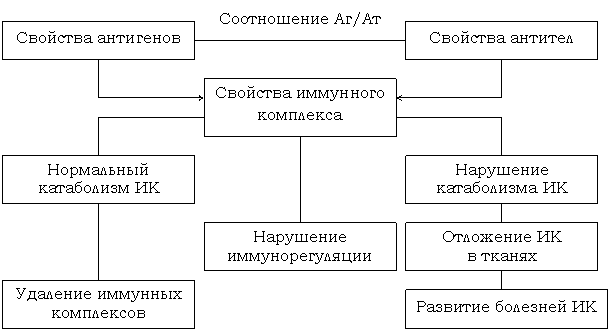
Синтезирующиеся при формировании иммунитета специфические антитела обладают способностью взаимодействовать с антигенами возбудителей и тем самым вызывать нейтрализацию патогенных микробов и их токсинов. Эта реакция сопровождается образованием иммунных комплексов антиген – антитело [33, 34, 54, 55]. При патологических состояниях образование ИК выходит из под контроля, в результате чего развивается та или иная болезнь ИК [рис. 1.3.2.].
Патогенетические механизмы болезней иммунных
комплексов (Сура В.В., 1987)
Реферат опубликован: 7/04/2005 (23765 прочтено)