Страница: 1/5
ОГЛАВЛЕНИЕ
Введение. 3
Механизмы действия наркотических анальгетиков. 5
Алкалоиды–производные фенантренизохинолина и их синтетические аналоги. 7
Морфин 9
Фармакологические эффекты 9
Фармакокинетика 10
Показания к назначению, дозировка 11
Побочные эффекты и противопоказания 12
Хранение и формы выпуска 12
Морфилонг 12
Фармакокинетика 12
Показания к назначению, дозировка 13
Хранение и формы выпуска 13
Омнопон 13
Показания к назначению, дозировка 13
Хранение и формы выпуска 13
Кодеин 14
Фармакологические эффекты 14
Показания к назначению, дозировка 14
Хранение и формы выпуска 15
Этилморфин (дионин) 15
Фармакологические эффекты 15
Показания к назначению, дозировка 16
Хранение и формы выпуска 16
Другие производные морфинана. 16
Производные пиперидина. 18
Промедол 18
Фармакологические эффекты 19
Фармакокинетика 19
Показания к назначению, дозировка 19
Противопоказания и побочные эффекты 20
Хранение и формы выпуска 20
Фентанил. 20
Фармакокинетика 20
Показания к назначению, дозировка 20
Хранение и формы выпуска 21
Производные циклогексана. 21
Трамадол. 21
Производные дифенилэтоксиуксусной кислоты. 22
Эстоцин. 22
Введение.
Анальгезирующими средствами, или анальгетиками ( от греч. algos – боль и an – без), называют лекарственные средства, обладающие специфической способностью ослаблять или устранять чувство боли, т.е. средства, доминирующим эффектом которых является анальгезия, наступающая в результате резорбтивного действия и не сопровождающаяся в терапевтических дозах выключением сознания и выраженным нарушением двигательных функций. По химической природе, характеру и механизмам фармакологической активности современные анальгетики делят на две основные группы: Наркотические и ненаркотические анальгетики. Настоящий реферат посвящен обзору наркотических анальгетиков, их классификации, особенностям фармакологического действия.
Для наркотических анальгетиков, в отличие от ненаркотических, характерны следующие основные свойства:
Сильная анальгезирующая активность, обеспечивающая возможность их использования в качестве высокоэффективных болеутоляющих средств в различных областях медицины, особенно при травмах и заболеваниях, сопровождающихся выраженным болевым синдромом;
Особое влияние на ЦНС человека, выражающееся в развитии эйфории и появлении при повторном применении синдромов физической и психической зависимости;
Развитие болезненного синдрома – абстиненции у лиц с развившимся синдромом физической и психической зависимости при лишении их анальгетического препарата;
Снятие вызываемых токсических явлений на ЦНС, нарушений сердечной деятельности, а также анальгезии специфическими антагонистами.
Фармакологические эффекты при приеме наркотических анальгетиков обуславливаются их механизмами действия (см.) и заключаются в следующем: кроме анальгетического эффекта, все наркотические анальгетики в той или иной степени оказывают снотворное действие, угнетают дыхание и кашлевой рефлекс, повышают тонус кишечника и мочевого пузыря, вызывать диспепсические расстройства (тошноту, рвоту), нарушения со стороны ЦНС (галлюцинации) и другие побочные явления.
По выраженности анальгетического действия и побочным эффектам разные препараты группы наркотических анальгетиков различаются между собой, что связано с особенностями их химической структуры и физико-химическими свойствами и соответственно со взаимодействием с рецепторами, вовлеченными в осуществление их фармакологических эффектов.
По источникам получения и химическому строению современные наркотические анальгетики делятся на 3 основные группы:
Природные алкалоиды — морфин и кодеин, содержащиеся в маке снотворном (Papaver somniferum) в нативном состоянии;
Полусинтетические соединения, полученные путем химического видоизменения молекулы морфина — этилморфин и др.;
Синтетические соединения, полученные методом полного химического синтеза и не имеющие аналогов в природе — промедол, трамадол, фентанил и др.
По химическому строению основной части молекулы наркотические анальгетики делятся на 4 основные группы:
Производные фенантренизохинолина (морфинана) и близкие по структуре соединения;
Производные фенилпиперидина и N-пропилфенилпиперидина;
Производные циклогексана;
Ациклические (производные дифенилэтоксиуксусной кислоты и схожие по структуре)
Большинство синтетических и полусинтетических препаратов получены путем химического видоизменения молекулы родоначальника группы наркотических анальгетиков – морфина с сохранением элементов его структуры или ее упрощением. Этим путем был создан ряд препаратов, различающихся по силе и степени развития анальгетического эффекта, по быстроте и степени развития привыкания, пристрастия и других побочных эффектов, по силе воздействия на различные отделы ЦНС, по способности тормозить двигательную функцию кишечника и др. Путем химического видоизменения молекулы морфина были также получены его антагонисты (налоксон и др.).
В настоящее время, когда механизм действия наркотических анальгетиков почти полностью установлен и выделены медиаторы опиатных рецепторов, препараты–медиаторы проходят клинические испытания и, возможно, в скором времени в каких-то случаях частично заменят наркотические анальгетики.
Механизмы действия наркотических анальгетиков.
Нейрофизиологические исследования свидетельствуют об угнетении наркотическими анальгетиками таламических центров болевой чувствительности и блокировании передачи болевых импульсов к коре. Этот эффект является, по всей вероятности, ведущим в физиологическом механизме анальгетического действия наркотических анальгетиков. Угнетение передачи болевых импульсов наркотическими анальгетиками происходит, по-видимому, на уровне таламуса. Болеутоляющее действие также связано с нарушением функции ассоциативных и неспецифических ядер таламуса и их связи с корой головного мозга. Одновременно блокируется передача нервных импульсов с коллатералей специфических путей на ретикулярную формацию ствола головного мозга.
Роль психического состояния в развитии анальгетического эффекта наркотических анальгетиков очень велика. Достаточно отметить, что положительный эффект «плацебо» (лекарственной формы, не содержащей активного препарата) достигает 30–40%. Изменение восприятия боли связано с эйфорией, диссоциативном эффекте наркотических анальгетиков, их успокаивающем действии. Последнее сказывается на оценке боли и ее вегетативных проявлениях.
В нейрохимическом аспекте большое значение имеет изучение влияния этих веществ на нейромедиаторные процессы мозга и периферических органов. В нервной системе человека имеется сложная антиноцицептивная (противоболевая) система, включающая энкефалиновые пресинаптические тормозящие рецепторы (см. рис. 1). В качестве нейротрансмиттеров (медиаторов) передачи импульса в этих рецепторах выступают олигопептиды: эндорфины и энкефалины, а также другие пептиды (динорфины и др.). По химической природе эти соединения состоят из нескольких остатков аминокислот, например, мет-энкефалин состоит из 5 аминокислот, а b-эндорфин из 31 аминокислоты. Они не являются типичными нейромедиаторами, поскольку по способу выделения из нейронов и трансмиссии через нейронную жидкость к другим нейронам они аналогичны нейрогормонам, а по типу действия являются модуляторами, участвующими в снижении чувствительности к боли, в передаче импульса на другой нейрон. Эндорфины и энкефалины, связываясь с опиатными рецепторами, оказывают анальгетическое действие.
В настоящее время установлено, что опиатные рецепторы существуют в виде нескольких субпопуляций: m, c, d, s, имеющих различную функциональную значимость. Полагают, что m–рецепторы определяют супраспинальную анальгезию, эйфорию, угнетение дыхания и физическую зависимость; c–рецепторы определяют спинальную анальгезию, миоз, седативный эффект; s–рецепторы влияют на восприятие действительности (считают, что эти рецепторы играют важную роль в патогенезе шизофрении).
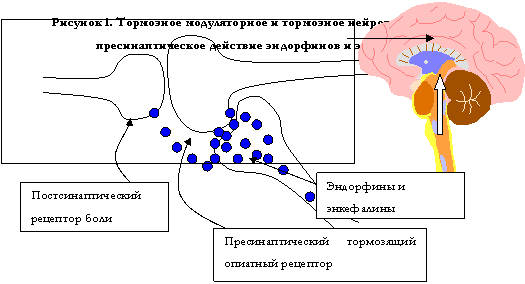
Опиатные рецепторы представляют собой быстрые ион–канальные рецепторы, которые в физиологических условиях активируются олигопептидами (эндорфинами и энкефалинами) возможно, при участии аминокислоты глицина. Наркотические анальгетики связываются с опиатными рецепторами, т.е. являются блокаторами открытых каналов. Во время открытия ионного канала, анальгетик поступает в него, связывается и препятствует переходу ионов в канал. При этом потенциал действия на пресинаптической части нейрона, проводящего болевой импульс, не возникает и происходит развитие торможения в этом нейроне. Есть мнение, что действие экзогенных наркотических анальгетиков связано также со стабилизацией эндогенных нейропептидов путем инактивации энкефалиназ – ферментов, разрушающих эндорфины и энкефалины.
Связывание наркотических анальгетиков с опиатными рецепторами обусловлено тем, что определенная часть молекулы всех наркотических анальгетиков имеет структурное и конформационное сходство с частью молекул (тирозиновым остатком) энкефалинов и эндорфинов. У природных опиатных нейропептидов конформационная структура молекулы строго определена четвертичной структурой белка, поэтому различные нейропептиды воздействуют только на те опиатные рецепторы, с которыми они имеют конформационное сходство. У наркотических анальгетиков молекула имеет значительные расхождения в расстояниях между активными центрами и конформационной структуры в сравнении с опиатными рецепторами. Это объясняет факт, что наркотические анальгетики действуют в гораздо более высоких дозах (по сравнению с эндогенными опиатными пептидами), а также их неспецифичность действия (один и тот же наркотический анальгетик воздействует на различные субпопуляции опиатных рецепторов). В последнее время синтезированы наркотические анальгетики, избирательно воздействующие на определенные субпопуляции опиатных рецепторов. Примерами могут служить декстрометорфан (не используется в СНГ), который является средством, избирательно подавляющим кашлевой центр, без побочных эффектов, свойственных кодеину (является избирательным агонистом m– и s–рецепторов; побочный эффект заключается в развитии галлюцинаций и др. нарушений психики при использовании очень высоких доз (700–900 мг) вследствие возбуждения s-рецепторов); лоперамид, избирательно связывающийся с m-рецепторами кишечника и вызывающий в терапевтических дозах антидиарейный эффект без основных эффектов, свойственных наркотическим анальгетикам (скорее всего, за счет использования малой дозы или за счет того, что препарат плохо проникает через гематоэнцефалический барьер).
Различные наркотические анальгетики различаются также по характеру связывания с опиатными рецепторами. Одни из них (морфин, промедол, фентанил и др.) являются «чистыми» (полными) агонистами опиатных рецепторов; связываясь с ними, они оказывают характерное для эндогенных опиатных нейропептидов физиологическое действие. Другие (налоксон и др.), являясь «чистыми» антагонистами, связываются с опиатными рецепторами, блокируют действие эндогенных опиатных нейропептидов и чистых агонистов опиатных рецепторов. Третья, наиболее перспективная в фармакологическом отношении группа, представляет собой препараты смешанного типа действия (агонисты–антагонисты), по-разному связывающиеся с разными подтипами опиатных рецепторов и оказывающие в связи с этим двоякий эффект.
Действие наркотических анальгетиков на периферические органы (кишечник) обусловлено также связыванием с опиатными рецепторами, локализующимися в этих органах.
С опиатными рецепторами сопряжены нейроны, содержащие холинэргические синапсы. При использовании м-холиноблокаторов (например, атропина) анальгезирующая активность наркотических анальгетиков усиливается, а при совместном использовании со средствами, снижающими уровень катехоламинов в ЦНС (симпатолитики, напр., резерпин), обезболивающее действие анальгетиков значительно снижается.
Алкалоиды–производные фенантренизохинолина и их синтетические аналоги.
Родоначальником этой группы, а также родоначальником всех наркотических анальгетиков является морфин, алкалоид, содержащийся в млечном соке мака снотворного (Papaver somniferum). Высушенный млечный сок из незрелых плодов мака снотворного называется опиумом (опием). Опий содержит около 25 алкалоидов (20–25% общей массы) в солях с молочной, меконовой (b-окси-l-пирон-a,a’-дикарбоновой), серной и другими кислотами. Основные алкалоиды опия — морфин, кодеин, папаверин, наркотин, тебаин либо сами применяются в качестве лекарственных средств, либо служат источниками получения их полусинтетических аналогов. Кроме алкалоидов в состав опия входят углеводы, белки, смолы, воски, жиры, пигменты и другие вещества. Разделение смеси алкалоидов опия представляет собой сложный и трудоемкий процесс. В России широко применяют метод Каневской–Клячкиной, отличающийся простотой и позволяющий произвести разделение с неплохим выходом и более-менее высокой степенью чистоты.
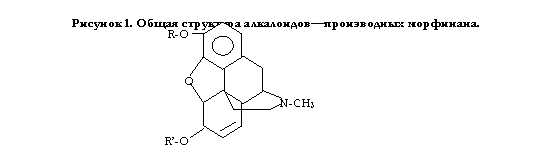
Опий содержит алкалоиды двух основных групп: производные 1-бензилизохинолина и морфинана. Свойствами наркотических анальгетиков, однако, обладают только производные морфинана, что связано, по-видимому, наличием пиперидинового кольца, замещенного в 2, 3, 4 положении объемными радикалами.
В настоящее время, хотя и полный химический синтез морфина и др. алкалоидов этой группы осуществлен, природные источники обеспечивают покрытие потребности в морфине, т.к. синтез весьма трудоемкий и выход морфина незначителен.
В зависимости от заместителей при 3, 6, 17 положении в молекуле морфинана его производные оказывают различные фармакологические эффекты. Безусловно, все основные эффекты наркотических анальгетиков присущи всем препаратам этой группы, но некоторые из них становятся преобладающими.
В таблице 1 приведена взаимосвязь химических свойств и фармакологического эффекта в зависимости от структуры производных морфинана. Морфин и этилморфин применяют в медицине в виде гидрохлоридов, а кодеин — в виде основания и фосфата. Все препараты представляют собой кристаллогидраты, которые на воздухе постепенно выветриваются, теряя кристаллизационную воду.
Реферат опубликован: 23/05/2005 (22376 прочтено)